Термодинамическое моделирование химических реакций и процессов
Моделирование стало неотъемлемой частью современной химии, дополняя и зачастую превосходя традиционные экспериментальные методы. В отличие от лабораторных экспериментов, моделирование предоставляет уникальные возможности, которые значительно ускоряют и упрощают исследовательский процесс:
- Экономия времени и ресурсов;
- Безопасность;
- Детальное понимание происходящих превращений;
- Исследование широкого диапазона условий;
- И пр.
В настоящее время в Интернете достаточно широко освещен вопрос методов моделирования, позволяющих рассчитать структуру и свойства отдельных молекул (квантово-химические и другие расчеты), поэтому в данной статье мы их касаться не будем.
В различных разделах науки химия стоит свой широкий спектр задач. Одной из задач химической термодинамики (как части физической химии) является определение направления протекания химических реакций.
 Подобно тому, как шар на неровной поверхности под действием силы тяжести катится до тех пор, пока не окажется в состоянии равновесия, так же и любая химическая система движется в сторону термодинамического равновесия. Только движением в данном случае является протекание химических реакций и фазовых переходов, а равновесием – конкретный качественный и количественный состав системы.
Подобно тому, как шар на неровной поверхности под действием силы тяжести катится до тех пор, пока не окажется в состоянии равновесия, так же и любая химическая система движется в сторону термодинамического равновесия. Только движением в данном случае является протекание химических реакций и фазовых переходов, а равновесием – конкретный качественный и количественный состав системы.
При смешении двух простых веществ при комнатной температуре мы легко сможем рассчитать, склонны ли они к химическому взаимодействию и какие продукты из них образуются. Для этого, например, достаточно выписать из справочника их энергии Гиббса и сравнить с энергией Гиббса возможных продуктов реакции (с учетом стехиометрии).
Однако с ростом количества компонентов в системе задача нахождения равновесного состава многократно усложняется. И рассчитать равновесный состав шихты при синтезе, например, сложной люминофорной композиции вручную не представляется возможным.
Для этого необходимо использовать методы термодинамического моделирования. Один из них, разработанный профессором СПбГТИ(ТУ) Александром Арсеньевичем Слободовым, мы рассмотрим в данной статье.
Термодинамическое моделирование по методу Слободова
С точки зрения химической термодинамики любая система стремиться в состояние равновесия, которое характеризуется (в изобарно-изотермических условиях) минимумом свободной энергии Гиббса.
Энергия Гиббса системы складывается из энергий Гиббса всех веществ, которые в нее входят:
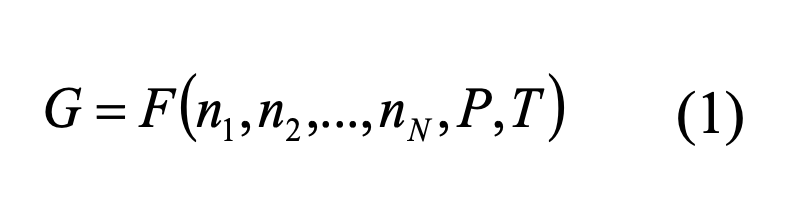
Решая математическую задачу поиска минимума данной функции, мы получаем равновесные количества веществ, т.е. качественный и количественный состав системы.
Метод термодинамического моделирования состоит из следующих шагов:
- Постановка задачи: известен начальный (или любой другой) состав системы (качественный и количественный).
- На основе п. 1 составляется набор всех возможных химических веществ, способных образоваться из химических элементов в любом их сочетании (с соответствующими термодинамическими характеристиками).
- Находится выражение для функции (1).
- Решается задача поиска минимума полученной функции с учетом ограничений неизменности количества вещества для всех интересующих нас значений параметров состояния (температура, давление).
Выражение функции (1) будет зависеть от ограничений, которые мы решим наложить на нашу систему, например:
- Возможность или невозможность образования газов;
- Возможность или невозможность образования конденсированных растворов;
- Возможность или невозможность образования водных растворов.
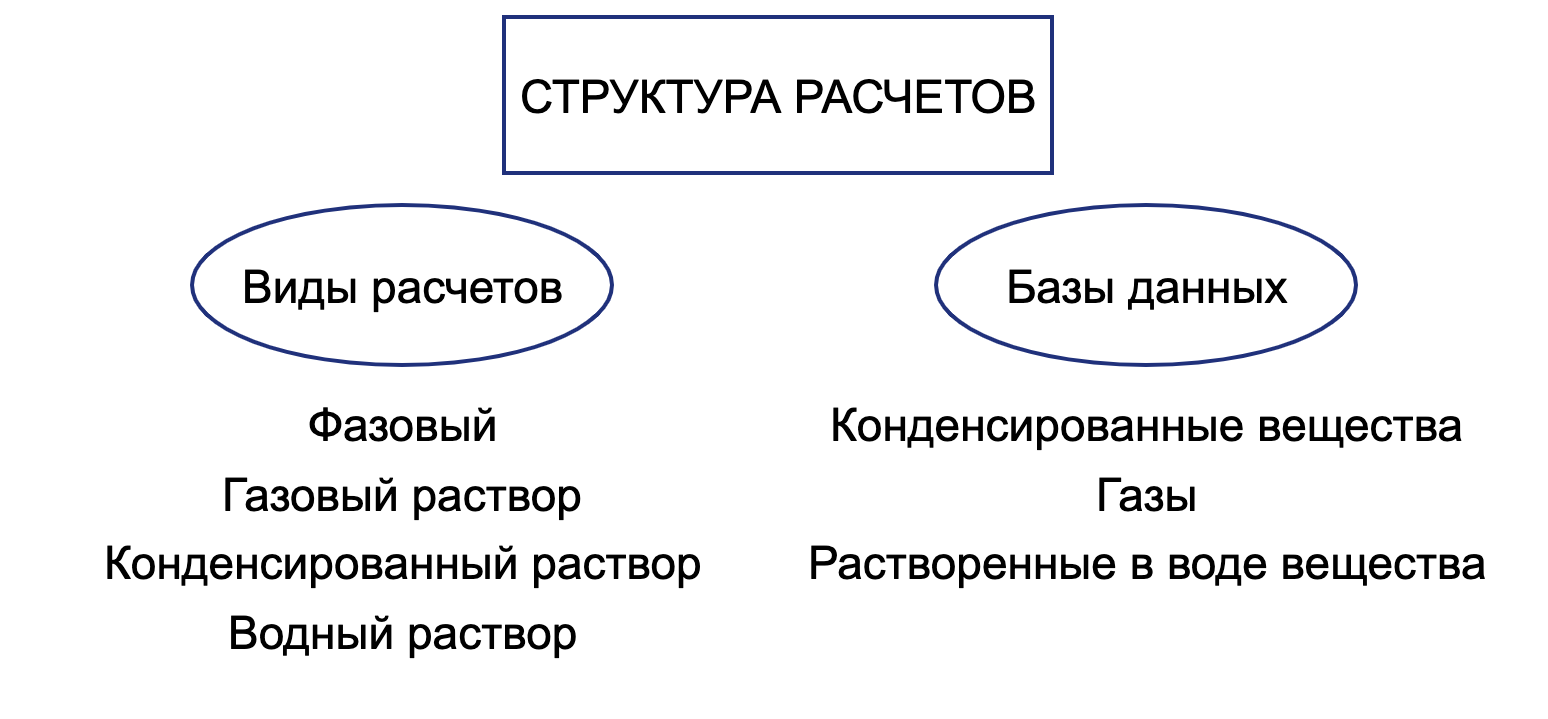
Сочетание вида (видов) расчета и базы (баз) данных позволяет учесть различные условия протекания физико-химических взаимодействий и максимально приблизить модель к реальности.
Пример результатов расчета керамической композиции в процессе синтеза приведен на следующем рисунке:
Прочитать подробнее про данный метод термодинамического моделирования можно в книге «Компьютерное моделирование химических взаимодействий». Для осуществления таких расчетов был создан сервис, доступный по адресу SlobodovReactor.ru .
